Solutions d'optogénétique
L'optogénétique est une technique qui utilise la lumière pour stimuler ou inhiber l'activité neuronale des neurones sensibles à la lumière génétiquement modifiés. Doric Lenses propose un large éventail de produits intégrés verticalement pour la délivrance de lumière optogénétique pour des expériences in vitro, aiguës ou en mouvement libre sur des animaux. Ces dernières comprennent des sources lumineuses, des cordons de raccordement à fibre optique, des séparateurs de faisceau, des joints rotatifs à fibre optique et des canules à fibre optique.

Source de lumière
Le choix de la source lumineuse appropriée pour la livraison de la lumière dans les tissus biologiques via une fibre optique dépend des paramètres suivants:
- longueur d'onde [nm]
- puissance optique [mW] ou intensité à l'extrémité de la fibre [mW / mm²]
- capacités de modulation d'intensité lumineuse
- stabilité de puissance
La gamme de longueurs d'onde de la source lumineuse doit être adaptée aux spectres d'action de l'opsin donné. L'une des opsines les plus couramment utilisées est la channelrhodopsine (ChR2) qui a une bonne réponse en photocourant de 430 à 490 nm avec un pic autour de 470 nm.
Les autres aspects à prendre en compte lors de la sélection de la source lumineuse et d'autres parties de l'installation sont:
- taille de fibre optique ou zone (s) cible (s)
- nombre de sites: sites unilatéraux, bilatéraux ou multiples
- contrôle commun ou indépendant pour plusieurs sites
- un implant chronique ou une sonde aiguë
- l'expérience avec un animal en mouvement libre peut nécessiter des joints rotatifs à fibre optique
Les expériences pourraient combiner différentes opsines ayant une réponse spectrale différente, ou des marqueurs fluorescents nécessitant plusieurs sources de lumière et combinateurs de faisceaux. Notre service client vous aideras à sélectionner le matériel optique le mieux adapté à vos expériences d'optogénétique.
Canules à fibre optique (ou pointe de sonde)
Pour optimiser la diffusion de la lumière dans les tissus biologiques, le diamètre de noyau de fibre optique et l'ouverture numérique doivent être soigneusement sélectionnés. Le diamètre le plus grand du noyau de la fibre optique apporte de la lumière sur une plus grande surface, tout en endommageant davantage le tissu. Une ouverture numérique plus élevée diffusera la lumière à un angle de cône plus grand et transmettra plus de puissance lorsque vous travaillerez avec une source de lumière incohérente comme DEL, communément appelé LED. Les fibres optiques à ouverture numérique élevée ne sont en général pas aussi robustes que la version à ouverture numérique inférieure en raison de la différence de fabrication des fibres.
Le choix du connecteur fibre optique, soi-disant le réceptacle de canule, dépend du type d'expérience et du modèle animal sélectionné. La connexion la plus simple et la plus courante est la virole de manche de 1.25 ou 2.5 mm de diamètre. En raison du plus petit encombrement et de la connexion relativement bonne. Cependant, la connexion nécessite une certaine habileté et peut extraire une pression non négligeable sur l'animal. Des solutions alternatives sont proposées, par exemple, si l'expérience nécessite plusieurs connexions et déconnexions, le connecteur magnétique pourrait être une solution. Si l'expérience implique des animaux plus gros et plus actifs, le connecteur à vis M3 fournit une connexion sécurisée et fiable.
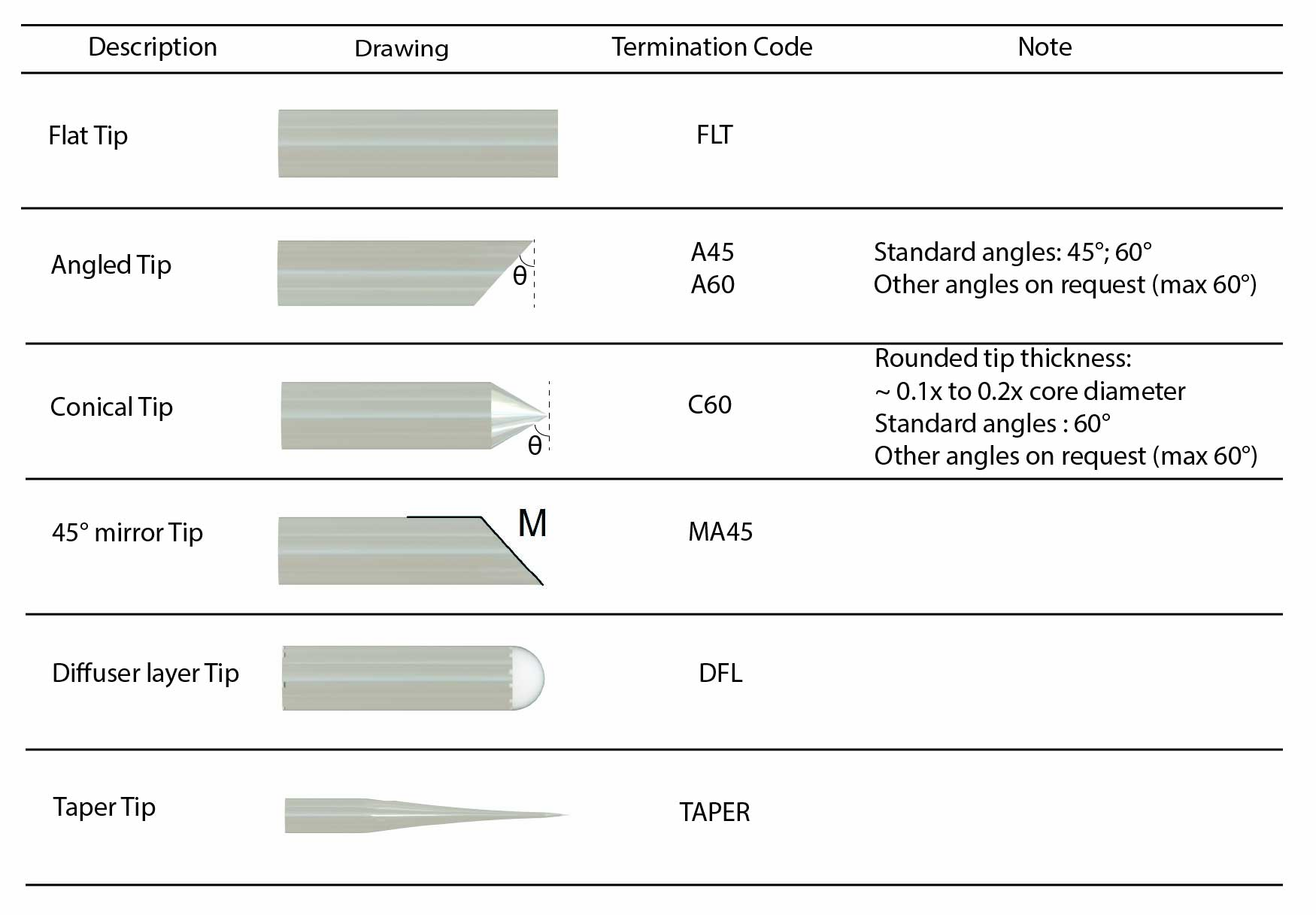
Enfin, le forme de la pointe de la fibre optique peut aider à optimiser la distribution de l'éclairage optogénétique ou à minimiser les lésions tissulaires collatérales. Voici une courte liste des embouts de fibres disponibles:
- Clivé: Une pointe clivée est la solution la plus économique, mais pas très précise ni reproductible.
- Bout plat ou Flat Tip (FLT): La terminaison à pointe plate fournit une pointe de fibre polie et une longueur de saillie précise. Lorsqu'il est implanté dans le cerveau, il délivre un cône étroit de lumière devant la fibre.
- Angle (A) : La terminaison angulaire implique le polissage de la pointe de fibre à un angle choisi. Cela permet une pénétration plus facile des fibres dans les tissus. Lorsqu'il est immergé dans des tissus biologiques à indice de réfraction élevé et hautement diffusant, la distribution de l'intensité lumineuse est presque la même que celle de la pointe plate.
- Cône (C): La terminaison de cône implique le polissage de la pointe de fibre dans un cône d'angle extérieur. Cela permet une pénétration plus facile des fibres dans les tissus. Lorsqu'il est immergé dans des tissus biologiques à indice de réfraction élevé et hautement diffusant, la distribution de l'intensité lumineuse est presque la même que celle de la pointe plate.
- Miroir d'angle (MA): La terminaison du miroir angulaire implique le polissage de la pointe de la fibre à un angle choisi, généralement 45 degrés avec un revêtement miroir ajouté sur la surface polie pour rediriger la lumière latéralement.
- Conique: Les fibres coniques sont tirées pour donner une pointe pointue et étroite qui facilite la pénétration dans les tissus et réduit les dommages. La sortie de lumière de la pointe conique s'échappe tout le long du cône, car l'angle de réfraction de la lumière dépasse l'angle critique et n'est plus guidé le long de la fibre. Cela peut être utilisé pour éclairer un plus grand volume et éviter une intensité lumineuse élevée localisée à l'extrémité de la fibre.
- Laser à double fréquence ou Dual Frequency Laser (DFL): La terminaison du laser implique l'ajout d'un matériau diffusant à l'extrémité de la fibre. Cela augmente la diffusion angulaire du rendement lumineux de la fibre par rapport à l'angle de faisceau de sortie relativement petit d'une pointe plate et aide à éclairer plus de neurones d'intérêt pour les expériences d'optogénétique ou d'électrophysiologie.
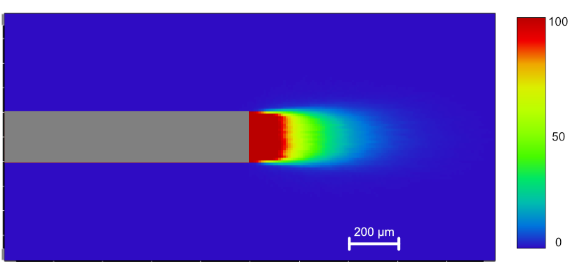
La propagation de la lumière dans le tissu cérébral varie en fonction du type de fibre optique et des paramètres de la source lumineuse. Il peut être visualisé dans ce Note d'application (la version française est disponible ici).
Références externes
|
1. Noemi Rook et coll. AAV1 est le vecteur viral optimal pour les expériences optogénétiques chez les pigeons (Columba livia). Commun Biol.4, 100 (2021). Région du cerveau: entopallium (zone visuelle primaire importante chez le pigeon) |
| 2. Fernández-García et coll. La stimulation du striatum cortex-dorsolatéral M2 inverse les symptômes moteurs et les déficits synaptiques dans la maladie de Huntington. eLife 9, e57017 (2020). Région du cerveau: cortico-striatale (M2-DLS) |
| 3. Brendan D. Hare et coll. La stimulation optogénétique des neurones Drd1 du cortex préfrontal médian produit des effets antidépresseurs rapides et durables. Nature Communications 10, (2019). Région du cerveau: cortex préfrontal médian (mPFC) |
|
4. Michelle M. Sidor et coll. Stimulation optogénétique in vivo du système nerveux central des rongeurs. J.Vis. Exp.95, e51483 (2015). Région du cerveau: zone tegmentale ventrale |
|
5. Gradinaru V et coll.Stratégies de ciblage et de lecture pour un contrôle neuronal optique rapide in vitro et in vivo. J Neurosci, 27, 14231-8 (2007). |
| 6. Addgene Optogenetics Guide |
| 7. Ressource d'optogénétique du laboratoire Deisseroth |
